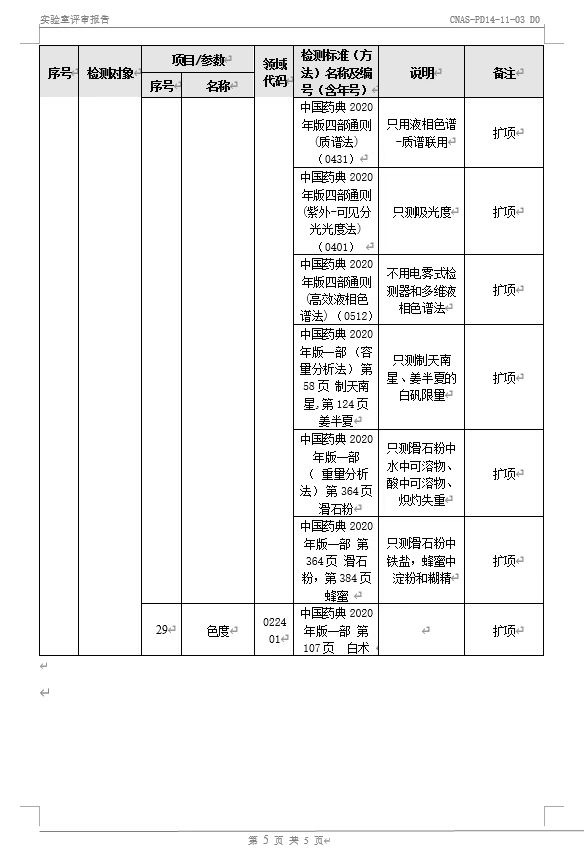
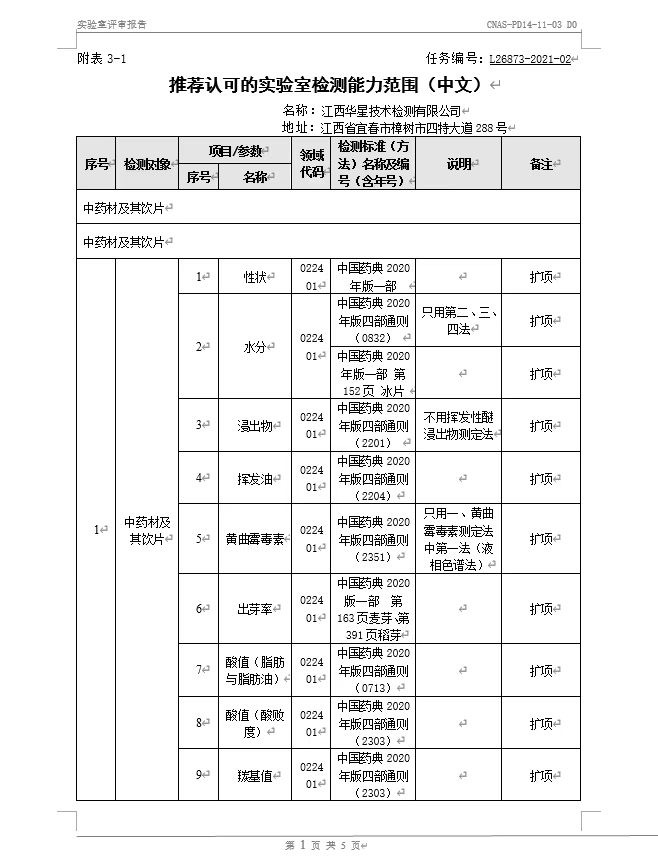
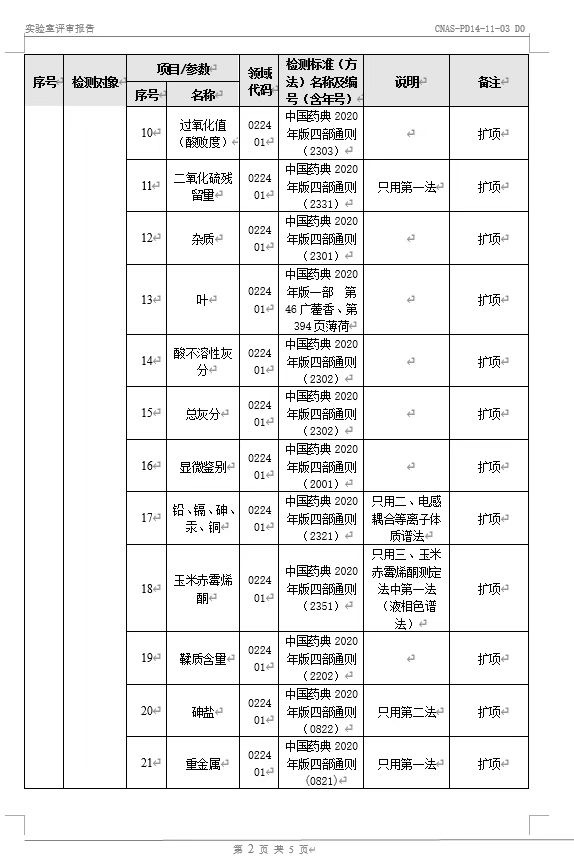
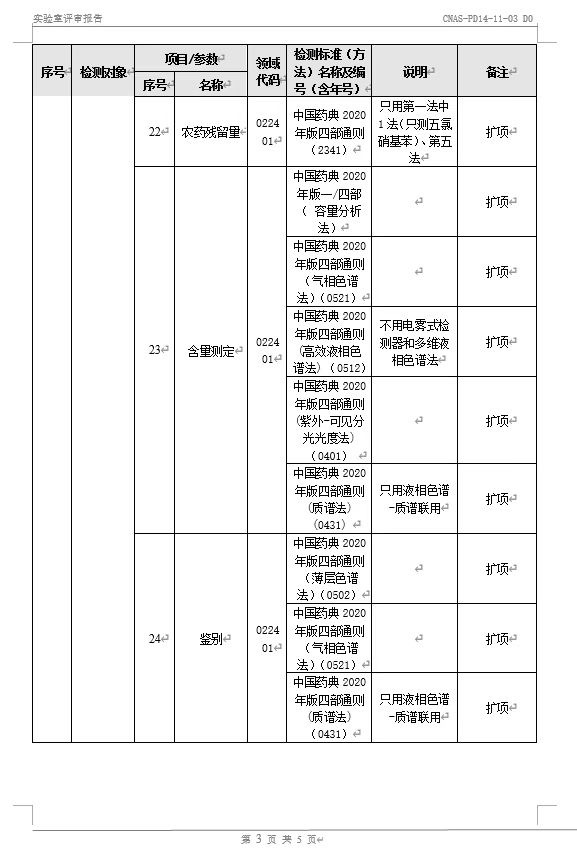
10月30日至31日,中国合格评定国家认可委员会(CNAS)专家评审组对华星检测进行了为期两天的“复评审+变更”线上评审并获专家组一致同意顺利通过。
首次会上,总经理叶维军致辞,对评审组表示热烈欢迎并详细介绍了公司的发展历程;评审组组长路桂芬对这次评审工作进行了部署和安排。公司各部门负责人及关键岗位员工参加了首次会议。与会人员还一同观看了公司宣传片。
评审期间,评审组通过网络会议、录像、传输资料审核等方式对本公司的管理体系、设施环境、技术能力、质量控制、授权签字人等进行了全面的审核,评审组对华星检测的管理体系和项目实施等方面分别给出了客观的评价。
末次会上,CNAS评审组一致认为华星检测管理体系能够持续有效运行,满足CNAS相关要求;充分肯定了华星检测此次监督评审的专业能力、管理水平以及改进机制;对公司员工展现出的良好精神风貌、优秀职业素质及积极蓬勃的工作氛围给予了赞扬;同时针对发现的问题和不足给出了建设性的意见和指导。
总经理叶维军代表华星检测向CNAS评审组的辛勤工作和指导帮助表示感谢,接受评审组提出的宝贵意见并表达了持续改进工作质量的决心,此次评审是对华星检测的一次全面体检。今后,华星检测以CNAS认可为契机,进一步加强管理工作,保障管理体系不断得到持续改进和完善,继续秉承“传递信任、提升价值”的理念,不忘初心,依法合规从事认证活动,进一步提升为客户提供高质量认证服务的水平。




 微信服务号
微信服务号